Ecuación Química
Notación de las reacciones
Los cambios químicos se representan o escriben mediante lo que denominamos como ecuación química.
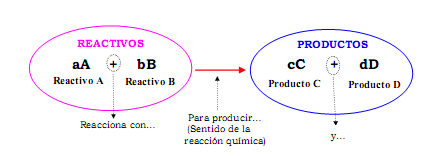
En una ecuación química los reactivos se escriben a la izquierda y los productos a la derecha y en medio una flecha.
FIGURA 5-1: Esquema general de representación de una reacción química mediante una ecuación química. Ejemplo de dos reactivos A y B que dan dos productos C y D.
Además en las ecuaciones químicas se puede indicar entre otros datos: el estado de agregación de las sustancias, la temperatura y presión de la reacción, la presencia de catalizadores o inhibidores, la energía de reacción, etc.
Justificación del ajuste químico:
Dado que los átomos se conservan en las reacciones químicas, debe haber el mismo número y tipo de átomos en los reactivos y en los productos.
Ajustar una reacción consiste en colocar unos "números" delante de cada una de las fórmulas de los reactivos y productos, llamados coeficientes estequiométricos, que multiplican el valor del número de átomos del compuesto al que precede.
Dicho con otras palabras, el coeficiente estequiométrico de un compuesto indica cuantas veces está presente ese compuesto en la reacción química.
Toda reacción debe estar ajustada.
Existen fundamentalmente dos métodos de ajustes de reacciones: el método de tanteo y el de los coeficientes indeterminados.
Método de ajuste por tanteo
Este método consiste en probar con diferentes valores para los coeficientes estequiométricos hasta que se cumpla que haya el mismo número de átomos de cada tipo en productos y reactivos.
Una reacción puede estar ajustada para diferentes valores de los coeficientes estequiométricos. Los coeficientes también pueden tener valores fraccionarios.
Normalmente se ajustan las reacciones dando el menor valor posible a los coeficientes, evitando los coeficientes fraccionarios.
Método de los coeficientes indeterminados
Los pasos para aplicar este método de ajuste de ecuaciones químicas son los siguientes:
1. Cada uno de los coeficientes se considera una incógnita que se representa con una letra.
2. Se construye una ecuación para cada elemento químico. Para ello se multiplica cada coeficiente por el subíndice del elemento que estemos considerando, se suman todos los términos de esta multiplicación de los reactivos y se igualan a los de los productos.
3. Se construye un sistema de ecuaciones que tendrá tantas ecuaciones como elementos químicos diferentes tenga la reacción química.
4. Se asigna un valor arbitrario (el que se quiera) a cualquiera de los coeficientes. Normalmente se procura que sea uno sencillo.
5. Se resuelve el sistema de ecuaciones, y se coloca en la reacción química el valor de los coeficientes calculados. Si se desea se puede simplificar el resultado dividiendo todos los coeficientes por un mismo valor.
Veamos ahora la diferencia entre Ecuación y reacción Química
- REACCIÓN QUÍMICA
Es el proceso en el que, por una redistribución de átomos de un sistema material inicial formado por una o más sustancias (llamadas reactivos), se obtiene una o más sustancias con propiedades químicas y físicas diferentes (llamadas productos).
En el lenguaje químico, las reacciones químicas se representan mediante las ecuaciones químicas.
- ECUACIÓN QUÍMICA
Es la representación de una reacción química en la que se indica la clase y cantidad de cada una de las sustancias que participan en ella y el sentido de la reacción. Si es conveniente, se indica también el estado de agregación en que se encuentran las sustancias participantes.
La clase de sustancia se representa mediante su fórmula química.