Enlace Químico
Concepto
Los átomos pueden unirse entre si formando lo que se llama un enlace químico.
La razón de que los átomos se unan tenemos que buscarla en la mayor estabilidad energética que adquiere el sistema de átomos al unirse: cuanto menor es el contenido en energía de un sistema, mayor estabilidad tiene.
No todos los átomos tienden a unirse, los gases nobles están constituidos por átomos individuales.
La estabilidad energética de los átomos de los gases nobles se atribuye a su estructura electrónica (todos tienen 8 electrones en su último nivel), por ello se usa la regla del octeto para predecir si dos o más átomos formarán un enlace o no.
Los enlaces químicos son las fuerzas entre los átomos que constituyen un elemento o un compuesto.
Enlace iónico
Este enlace se produce cuando los átomos de los elementos metálicos (los situados más a la izquierda en la tabla periódica, períodos 1, 2 y 3), se encuentran con átomos no metálicos (los situados a la derecha en la tabla periódica, períodos 16 y 17).
En este caso los átomos del metal ceden electrones a los átomos del no metal, transformándose en iones positivos (cationes) y negativos (aniones), respectivamente. Al formarse iones de carga opuesta éstos se atraen por fuerzas eléctricas intensas, quedando fuertemente unidos y dando lugar a un compuesto iónico. A estas fuerzas eléctricas las llamamos enlaces iónicos.
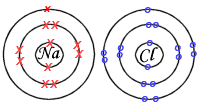
FIGURA 5-2: En el enlace iónico, los cationes y aniones se atraen debido a su carga eléctrica.
Enlace covalente
Este enlace se produce entre los átomos de los elementos no metálicos (los situados más a la derecha en la tabla periódica, períodos 14, 15, 16 y 17).
En este caso la tendencia a captar electrones es semejante entre los átomos. Los electrones se compartirán entre los átomos para quedar rodeados por 8 electrones (regla del octeto).
Hay dos tipos de sustancias a que da lugar este enlace: sustancias moleculares (formadas por moléculas) como el oxígeno y cristales covalentes como el diamante (donde todos los átomos se encuentran unidos en una red tridimensional).
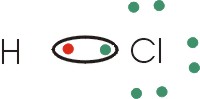
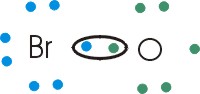
FIGURA 5-3: En el enlace covalente se comparten los electrones entre los átomos unidos.
Enlace metálico
Este enlace se produce entre los átomos de los elementos metálicos (los situados en la parte izquierda de la tabla periódica).
En este caso la tendencia a ceder electrones es semejante entre los átomos. Los electrones del último nivel (llamados electrones de valencia) se compartirán entre todos los átomos constituyendo lo que se llama nube o mar de electrones. Debido a esto, los metales son buenos conductores de la electricidad.
Los restos iónicos (con carga positiva) se ordenan en una red tridimensional formando un cristal metálico.
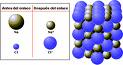
FIGURA 5-4: En el enlace metálico, todos los átomos comparten sus últimos electrones y los restos atómicos se disponen en una red cristalina.